ウェビナー登録についてのお知らせ
1)登録案内メールが到着していない場合:
ウェビナー登録のご案内を記したメールを6月19日に配信しております。
お手元に届いていない場合には、事務局atdd-frm@jfcr.or.jpまでご連絡ください
2)ウェビナー登録の際に、リンク先にアクセスできない場合:
インターネットプラットフォームを変えて、アクセスをしてみてください。
以下のような情報をいただいておりますので、共有させていただきます。
- Internet ExplorerとGoogle Chromeはアクセスできなかったが、Microsoft Edgeはアクセスできた。
- Google Chromeでは立ち上がらなかったが、Internet Exploreは立ち上がった。
- リンクをInternet Explorerにコピーペーストしたところ,登録画面に移行することができた。
オンライン開催について(参加者の皆様へ)
受信映像や発表資料の保存(画面キャプチャを含む)、録音、再配布を禁止します。
無用な音声の流入や不安定なネットワークからの接続などにより進行に支障があると判断される場合には、事務局・座長によってミュート操作を行ったり接続を切断したりする可能性があります。
Zoomについて
本フォーラムはZoom「ウェビナー」というオンライン会議室を使用して開催いたします。
事前にZoomへの接続性をテストできます。以下のURLをご参照下さい。
https://support.zoom.us/hc/ja/articles/115002262083
ウェビナーでは「パネリスト」と「参加者」という2つの役割があります。
| パネリスト | 音声の発信、ビデオの使用、画面共有ができます。 発表者と座長が「パネリスト」として参加します。 |
|---|---|
| 参加者 | 基本的に発表の視聴のみ可能です。質疑応答の際には発表者にQ&Aで質問をすることができます。その他、座長に指名された場合には音声にてご発言いただくことができます。 |
以下は一般的な注意事項です。
- Zoomにアクセスするときはアプリの使用を推奨します。アプリは無料でダウンロードできます。また、オンライン会議室に最初にアクセスするとアプリをダウンロードするように誘導されます。既にZoomアプリをインストールなさっている場合には、当日までに最新版にアップデートされていることをご確認下さい。
- Zoomのアカウントを作る必要はありません。アカウントがなくてもご参加、ご発表いただけます。
- ウェブブラウザによっては正しく動作しないことがありますので、事前に上記テストサイトに接続してご確認下さい。
- 以降の説明におけるZoomでの操作方法はPC版のアプリの使用を前提にしています。
フォーラムの聴講にあたって
Zoomウェビナー接続情報:「第29回抗悪性腫瘍薬開発フォーラム」案内のメールをご覧下さい
- 開始時間のおよそ5分前から入室できます。
- 今回のフォーラムでは視聴のみできます。ただし、座長に指名された場合には音声にてご発言いただくことができます。
- 質疑応答の際には発表者にQ&Aで質問をすることができます。Zoomアプリの画面下部にある「Q&A」ボタンを押すとQ&Aを開始します。
- 入力された質問は発表者に提示されます。また、パネルディスカッションの時間等で座長が代わりに読み上げて発表者に対して質問することがあります。
- 投稿された質問に「いいね」ボタンを押すことにより賛成票を投じる事ができます。
- Q&Aへの質問の入力は質疑応答の時間のみに入力下さい。発表の間の入力は、発表者の気をそらすことになる可能性があるため、お控えいただけますようお願いいたします。
- 当日にアンケートを実施いたします。こちらからhttp://atdd-frm.umin.jp/forum/29enq.htmlご回答をお願いいたします。(ウェビナー終了時にもお使いのブラウザにアンケートページが表示されます。)
当日の連絡先:
事務局メール(atdd-frm@jfcr.or.jp)にご連絡下さい。
フォーラム中はZoomのチャットでもご連絡いただけます。宛先については以下の表をご参照下さい。
| すべてのパネリスト | 座長、演者、事務局が閲覧可能 |
|---|---|
| すべてのパネリストおよび出席者 | 出席者(参加者)も含めた全員が閲覧可能 |
挨拶
抗悪性腫瘍薬開発フォーラムでは、新型コロナウイルス感染拡大防止に鑑み、第29回抗悪性腫瘍薬開発フォーラム(2020年6月27日(土))をオンラインにて開催することといたしました。
今回のフォーラムは、山田雅信実行委員長(医薬品医療機器総合機構)、齋藤宏暢副実行委員長(製薬協/第一三共株式会社)を迎え、「新たな規制制度における抗悪性腫瘍薬開発の新展開」をテーマに準備を進めております。
抗悪性腫瘍薬開発フォーラム
代表 門田 守人
公益財団法人がん研究会
第29回抗悪性腫瘍薬開発フォーラムについて
抗悪性腫瘍薬に限らず、効果が高く、安全性に優れた画期的な治療薬の開発が強く望まれています。そこで、最近の薬事規制においては、革新的医薬品等の実用化を加速するための様々な制度が導入されてきています。
中でも2015年に試行的に導入された「先駆け審査指定制度」は、世界に先駆けて開発される画期的な医薬品等について最大限に開発を加速して実用化を目指す制度です。これまでに5回の募集が行われ、現在までに、抗悪性腫瘍薬について9件(うち1件は指定取消)が指定されており、既に4件が承認されています。昨年12月には、薬機法が改正され、本制度や「条件付き早期承認制度」などが法制化されることになりました。
今回のフォーラムでは、第1部で、このような制度改革について森和彦先生(前厚生労働省大臣官房審議官)をお迎えして法改正を中心に革新的新薬へのアクセス推進等について解説していただき、更に先駆け審査指定制度に基づいて抗悪性腫瘍薬の承認を取得した企業の方から事例紹介をしていただきます。第2部では、アカデミアで抗悪性腫瘍薬の臨床開発を推進されている土井俊彦先生(国立がん研究センター)と吉野孝之先生(国立がん研究センター)に、開発の早期と後期に分けて、最近徐々に取り入れられるようになった、いわゆるアンブレラ・バスケット試験等の最近の開発の現状を紹介していただきます。
新型コロナウイルス感染症の蔓延により、開催延期も含めて検討してまいりましたが、今回は感染防止の観点からオンライン開催の形で実施することと致しました。開催にあたり、尽力いただいた本フォーラムの実行委員及び事務局各位に深く感謝申し上げる次第です。
最新の抗悪性腫瘍薬開発に係る規制制度や臨床開発の実際を知る貴重な機会となるようプログラムを企画致しましたので、多くの方々にご参加いただければ幸いです。
第29回抗悪性腫瘍薬開発フォーラム
実行委員長 山田 雅信
独立行政法人医薬品医療機器総合
開催概要
| 名称 | 第29回抗悪性腫瘍薬開発フォーラム 『新たな規制制度における抗悪性腫瘍薬開発の新展開』 |
|---|---|
| 日時 | 2020年6月27日(土) 午後1時〜 |
| 会場 | オンライン方式(Zoom ウェビナーを使用します) |
| 参加費 | 無料 本フォーラムへの参加は事前登録制となっております。 |
| 参加受付 | 参加登録締切:2020年6月18日(木) |
| 参加申込み方法 | 1. HPより参加登録をする。 2. 参加登録締め切り後、事務局よりウェビナー事前登録用のURLを送信 3. ウェビナーへの事前登録 4. 事務局より参加方法の詳細を送信 ※上記の方法がとれない方は事務局にご相談下さい。 |
| 事務局 | 〒135-8550 東京都江東区有明3-8-31 (公財)がん研究会がん化学療法センター 担当:三原 TEL:03-3570-0661 FAX:03-3570-0484 E-mail: atdd-frm@jfcr.or.jp |
第29回抗悪性腫瘍薬開発フォーラム参加登録フォーム
締め切りました。
第29回フォーラムアンケートまとめ
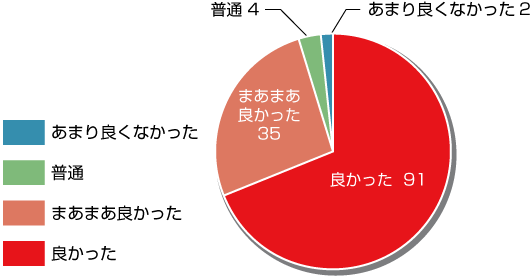
【総合評価】
回答数:132
良かった・まあまあ良かった:126
普通・あまり良くなかった:6
感想・意見
「良かった&まあまあ良かった」と回答
- 薬機法改正の考え方,先駆け審査指定制度と事例紹介,医師主導のアンブレラ・バスケット試験の相によるアプローチの違いなど,抗がん剤開発の潮流をとらえた内容であったと思いました。(他18件)
- 先生・当局・企業の視点がバランスよく含まれた発表内容・議論内容であったと思います。(他12件)
- 先駆け指定について,法制化の背景,実例,問題点とまとめて話を聞くことができ,とても良かった。(他11件)
- パネルディスカッションでは、齋藤氏のファシリテートが効果的で、特に規制当局のパネリストから興味深いコメントを引き出していた。(他7件)
- 早期の治験に日本から参加するために国立がん研究センター東病院がどんな工夫を行っているかについて、聞くことができたため(他6件)
- 新たな規制制度の設立背景、経験者の苦労や今後の展望など、非常に多岐にわたる話題ながら本質を突くご講演、ディスカッションを聞けて大変参考になりました。(他3件)
- 司会の山田先生,パネリストの森先生,吉野先生,土井先生のお話が大変良かった。
- 通常の集合形式と同様に開催できたと思います。
- それぞれのトピックについて適切な時間が取られていたこと。
- コロナの中外出しなくて済んだこと
- オンラインだったため質問をリアルタイムにできたこと
- QAセッションがチャットであったため盛り上がった。
- 吉野先生,土井先生のお話はやや複雑で,話も早く,理解できない部分があったのが残念だった。
- 関心のある内容であったが、一部自分の知識の範囲では理解が難しい内容があったため。
- 自身の興味からは少し外れていた
- パネルディスカッションではオンラインである点を活かして,話している論点や質問をスクリーンに映すなどと工夫もできたと思う。途中で議論についていけなくなったことが数回あった。
- 総合討論では、もう少しいろんな視点の話を聞きたかった(最後の議題まで話を持って行ってほしかった)
- パネルディスカッションの最後、医師主導治験成績とRWDの承認申請への利用の課題点について、規制側の観点からどのような課題があると考えているか、またその対応・措置についてどのようなアクションを取ろうと考えているか等具体的なビジョンが聴きたかったので、この点、時間切れになってしまったのが残念です。
「普通&あまり良くなかった」と回答
- 新卒社員のため、横文字が多くてついていけなかった。
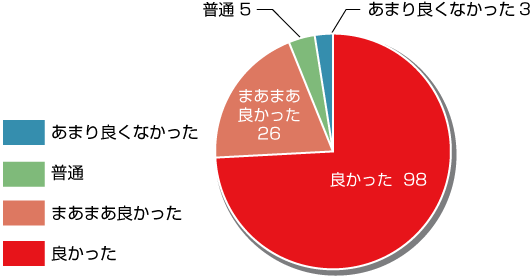
【オンライン開催について】
- 回答数:132
- 良かった・まあまあ良かった:124
- 普通・あまり良くなかった:8
感想・意見
「良かった&まあまあ良かった」と回答
- 会場に行く必要がなく参加しやすい(他34件)
- 発言が聞き取りやすく、スライドも鮮明だったので、いつもよりも理解が深まった。(他27件)
- 在宅での参加が可能であり,Work Life balanceの観点からも利便性の観点からも非常に良かった。若干途中で音声が途切れる等の課題はあったものの,是非次回以降もOnlineでの開催,もしくはOnlineとOn site双方の活用を考慮いただきたい。それにより,遠方などで参加が難しい方にも広く参加いただくことができ,抗悪性腫瘍治療の開発基盤の底上げが図れるものと考える。(他8件)
- チャットを活用した質疑応答が活発であった。(他7件)
- 話されている内容のメモなどが容易であったため。(他2件)
- 人の移動、会場のセッティング、質問者がマイク迄移動する等に時間を要しなかったせいか、時間通りに運用されたこと。(他1件)
- 音声上の問題はほぼなかった。
- 自宅の電波が悪く、聞こえない部分があった。
- 質問などについては、もう少し出るような形が取れるとよかったです。
- ポインタの表示がなかったので、少々わかりづらかった。
- 総合討論でもっと踏み込んで、Discussionしていただいても良かったように思います。なんとなく表面的な感じがしました。
- 演者/座長のやりとり時の雰囲気も楽しみにしているので,オンラインではそれがなかったのが,少し寂しかったです。
- 参加者の皆様と立ち話ができないのは残念です。
- 会場の雰囲気を感じることが出来ないが欠点かと思いますが、利点のほうがはるかに大きいと感じました。
「普通&あまり良くなかった」と回答
- Zoom参加で音声が聞こえず、電話で別途参加しました。
- Webセミナーは長時間の視聴は演者の身振りや聴衆の反応をみての対応など双方向のコミュニケーションが取れないため、特性上どうしても間延びしてしまうと感じた。
- 会場からの発言(応答も含む)がないため。
- 質問が限定されてしまうので、オンラインの限界を感じました。
- 会場まで足を運ぶ必要がないため、参加のハードルが下がり、より多くの方が参加されたのではないかと思います。一方、個人的にはミキサーの時間の歓談も楽しみにしていますので、現地開催できる日を楽しみにしています
【今後取り上げるべき、興味のあるテーマ】
【治療薬・治療法の開発】
- Agnostic therapyの開発の基本的考え方について
- Transorganな新薬開発
- 殺細胞系抗がん剤の特集や開発について
- 新たなプラットフォームの技術(ADC,がんワクチン,光免疫,がん免疫,CAR-T)のアップデート
- 免疫チェック阻害剤の開発と今後の展望
- 免疫療法におけるコストと有効性のバランス
【がん種ごとの課題】
- 各癌腫におけるアンメットメディカルニーズと開発状況
- 遺伝性腫瘍
- 希少がん、小児がん
- 小児やAYA世代のがんの創薬についてのアップデートを伺いたいです。
- 【診断・CDx】
- 本日も少し話題にでましたが、NGSパネルをCDxとして使用したときに、保険償還プロセス上(タイミング、価格ギャップ)があり実臨床で使用する際の課題となっていると思います。この解消に向けて専門の先生方にご議論いただければと思います。
- 診断薬やCDxの動向アップデート
- 横断的CDxのガイダンスを踏まえた今後のコンパニオン診断開発戦略について
- マイクロバイオームのご研究の状況を(がんに加えて認知症もということで)興味がありお話を伺いたい。
- より医療機関目線で取り入れることができる医療デバイスの紹介、そこから考えられる臨床試験へのベネフィット
【医師主導治験・試験デザイン】
- 医師主導治験の話を、医師側会社側の両方から伺いたいです。
- 医師主導治験と企業治験の垣根について
- 医師主導治験を担当した際、IRBからの指摘で医師主導治験にも関わらず監査担当者が製薬企業である、この体制はおかしい、と指摘されたケースを見たことがあります。
- 保険診療下のNGS、SCRUMをいかに新薬開発に活用するか。日本の早期開発を生き残らせる方策。Rare cancer/fractionの患者さんを中央集積する日本全体の方策。
- 新たな試験デザインの話を企業側から事例として聞きたい
- 希少がんを対象とした医薬品の有効性を評価する際の試験デザインについて。特に、単群試験において奏効が得られにくい薬剤の有効性をどのように評価するか。
- 有効レジメンの開発のコツ
【リアルワールドデータ・エビデンス】
- 本日ディスカッションに至らなかった、RWDを使った承認申請。データベース研究が進んでいるので、最新の研究と規制側の考えを知りたい。
- 本日時間がなく議論できなかった「医師主導型臨床試験成績やRWDの承認申請への活用における問題点」について、データの質及び規制当局側の見解をお伺いしたいです。(企業治験と全く同じ質を本当に担保する必要があるのか?)
- 今回議論しきれなかったRWDの利活用に係る実例,留意点,信頼性上の課題や,デジタル技術(dBM,PRO,DTx)の利活用。
- 本日、時間切れになったRWEの活用法についてのテーマは、製版後調査への活用を含めて、現状シェアなども有用と思います。
- RWD/RWEを活用した抗癌剤開発の可能性と課題について
- RWD活用の現状と展望
- リアルワードデータの信頼性について
- 医師主導試験やリアルワールドデータの承認申請への活用における問題点、等。
【AIほか】
- AIの開発への活用、Ptの参加
- 今回は産官学の中で産が製薬企業であったが、今日のセミナーを見て技術系企業、IT業など普段触れる機会がないジャンルとのセッションを期待したいです。前回はクラウド系の話題であってので、AIの分野などに興味があります。
- Digital technologyの活用の可能性について
- 抗がん剤開発におけるデジタルトランスフォーメーション
【規制・制度ほか】
- 薬機法施行後の承認審査の実例(規制及び企業の立場から)
- 本日のお話でも出ました、光免疫療法などやBNCTなど、薬剤と機器/Technicとの併用といった新しいコンセプトの薬剤開発とその規制について、お伺いできればと思っています。
- また次回も薬機法改定についてフォローいただけるとよいかと思います。
- 条件付き早期承認制度の実例とレギュレータ側からの問題点
- P1試験を継続し、そのまま申請に至るケースがあるが、そのあたりを企業および審査側はどうマネージしているのかを伺いたい。
- 承認された医薬品に関する、企業側の経験談については、引き続き取り上げていただけると良い。
- 試験立案時の患者意見反映の方法について
- 患者申し出療法制度について
- 患者中心医療の取り組みを臨床試験の枠組みに組み込んでいく際に、患者さん、医療機関、依頼者それぞれが留意すべきこと、実施すべきこと等。
【開発における諸課題】
- 抗悪性腫瘍薬の開発における、地域、施設格差をどうなくすのか。役割はどうあるべきか。議論を聞いてみたいです。今国立がんセンター2極集中であることは今日の議論を聞いてもわかります。ALL Japanと言う考え方や、地方は地方で、と言う考え方もあるかとも思います。
- 保険・個人情報の取扱い・医療経済学等も考慮した今後必要になるであろう社会構造の変革に係る基調講演とディスカッション
- 医療経済学
- 安全性マネージメントの理想と現実
- 承認審査における各極当局間の見解の相違傾向とあるべき姿について。例: region Aでは心毒性が危惧され、region Bでは遺伝毒性が懸念され、region Cではいずれも問題視されなかった・・・など。
【国際協働】
- 欧米海外の動向
- 時差の問題はありますが、オンラインであれば海外からの演者も招聘し易いので、国際協働に関するテーマでフォーラムを組んでもらっても良いかもしれません。
- ICH-E17をどのように抗悪性腫瘍薬開発に組み入れていくか
【テーマの方向性など】
- 新規機序、レギュレーション、標準治療
- 抗がん剤の開発に関することで、企業、医師、規制当局が何を考えているのか、改善すべきと思っているのかなど。
- アカデミア、企業のBusinessの方々や、医療課、財務省等の方々
- テーマに関しては現時点で思い浮かぶものがありませんが、今後もホットな内容を取り上げていただければと思います。全般的なこととしては、企業は自社の成功体験を自社の財産として秘密にしがちですが、できる限りオープンにすることにより、日本全体として開発力を高めていけるような場になればと思います。
- 時期は要検討かもしれませんが,デジタル治験の現状と課題,条件付き承認の事例,再生医療・細胞医療の事例,免疫チェックポイント阻害剤が世に出て約10年がたったと思いますでの,それを振り変えるとともに今後の展望と課題
- 都市伝説のような暗黙の了解や慣習(例:本日の議論のようにIITには企業は関与しない、PMDAは厳しい、医療機器でできることが医薬品でできないのか等)を検証し、規制改革につなげたり、環境やmind settingの変化につなげる
プログラム
第29回フォーラム実行委員会
| 委員長 | 山田 雅信(医薬品医療機器総合機構) |
|---|---|
| 副委員長 | 齋藤 宏暢(製薬協/第一三共株式会社) |
| 委員 | 青木 健洋(PhRMA/日本イーライリリー株式会社) 飯田 真介(名古屋市立大学) 稲垣 治(製薬協/アステラス製薬株式会社) 江夏 総太郎(PhRMA/日本イーライリリー株式会社) 清原 宏眞(医薬品医療機器総合機構) 熊谷 明子(EFPIA-J/ノバルティスファーマ株式会社) 河野 典厚(厚生労働省) 高見 朋子(PhRMA/MSD株式会社) 鶴岡 明彦(製薬協/エーザイ株式会社) 土井 俊彦(国立がん研究センター東病院) 山口 智宏(PhRMA/MSD株式会社) 山本 昇(国立がん研究センター中央病院) 吉野 孝之(国立がん研究センター東病院) 清宮 啓之((公財)がん研究会) 冨田 章弘((公財)がん研究会) 藤田 直也((公財)がん研究会) |