挨拶
第21回の抗悪性腫瘍薬開発フォーラムを、2016年6月25日(土)に開催いたします。
今回のフォーラムは、田村研治実行委員長(国立がん研究センター)、春日芳朋副実行委員長(欧州製薬団体連合会/中外製薬株式会社)、北川洋副実行委員長(欧州製薬団体連合会/ノバルティスファーマ株式会社)を迎え、「抗がん剤創薬に向けての次世代テクノロジーの展開 ~基礎から承認まで~」をテーマに、準備を進めております。
是非ご参加いただけますようお願いいたします。
抗悪性腫瘍薬開発フォーラム
代表
武藤徹一郎
公益財団法人がん研究会
第21回抗悪性腫瘍薬開発フォーラムについて
「抗悪性腫瘍薬開発フォーラム」は、産官学が一同に会し、日本における抗がん剤開発の問題点を、きわめて現実に即した形で徹底討論する、ユニークで推進力のあるシンポジウムです。10年にわたる歴史をふまえ、今回のテーマを「抗がん剤創薬にむけての次世代テクノロジーの展開~基礎から承認まで~」とさせていただきました。最近の分子標的薬剤を中心とする治験には、次世代シーケンスやliquid biopsy、免疫モニタリング手法など多くの新技術が導入され、患者選択のためのバイオマーカーの同定、コンパニオン診断薬の創出に応用されています。特に、多遺伝子、多がん種にわたる診断技術は急速な勢いで進歩しており、今後の治験の在り方を大きく変えることになりそうです。今回は、最新の診断技術に関する情報、治験内に組み込む際の具体的な問題点、規制の枠組みと薬事承認のあり方に焦点をあて、日本が世界をリードする抗がん剤開発を行うためには、今何をすべきかについて議論したいと考えています。抗がん剤開発に関わるあらゆる職種の方々(基礎研究者、医師、看護師、薬剤師、CRC、データマネージャー、製薬会社、医療機器会社、厚生労働省及びPMDAに所属する方など)に、是非ともご参加いただきたいと思います。
第21回抗悪性腫瘍薬開発フォーラム
実行委員長 田村 研治
国立がん研究センター
開催概要
| 名称 | 第21回抗悪性腫瘍薬開発フォーラム 『抗がん剤創薬に向けての次世代テクノロジーの展開 ~基礎から承認まで~』 |
|---|---|
| 日時 | 2016年6月25日(土)午後1時~6時5分 |
| 会場 | 吉田富三記念講堂(公益財団法人がん研究会がん研究所1F)アクセス 〒135-8550 東京都江東区有明3-8-31 |
| 参加費 | 4,000円(ミキサー費含む) 本フォーラムへの参加は事前登録制となっております。 |
| 参加受付 | 参加受付締切:2016年6月8日(水) ※定員になり次第、締め切らせていただきます。 |
| 参加申込み 方法 |
1. HPより参加登録をする。 2. 事務局より締切後、一週間程度で参加確認書をメールにて送信 3. 当日参加確認書を持参の上、参加費を受付で納入 ※上記の方法がとれない方は事務局にご相談下さい。 |
| 事務局 | 〒135-8550 東京都江東区有明3-8-31 (公財)がん研究会がん化学療法センター 担当:三原 TEL:03-3570-0661 FAX:03-3570-0484 E-mail: atdd-frm@jfcr.or.jp |
第21回抗悪性腫瘍薬開発フォーラム参加登録フォーム
締め切りました。
プログラム
第21回フォーラムアンケートまとめ
感想・意見
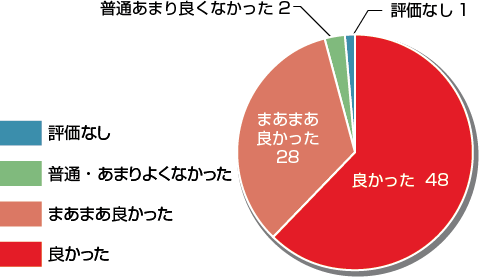
総合評価「良かった&まあまあ良かった」と回答
- 現時点での非常にホットな部分について、各専門の先生方からお話を聞くことができた。(同様26件)
- 最新技術→企業の取り組み→レギュレーションとアジェンダが全般的に網羅されており、多角的な発表でよかった。(同様15件)
- NGSの通知やFDAでのPlasma用EGFR CDx承認など、新しい話題について、日本での議論がされたから。(同様9件)
- 時間が不足していて、少し物足りなかった。パネルディスカッションを充実させると良いのでは。全体としては、演題、内容とも満足。(同様6件)
- 全体としては興味深く話を聞いた。しかし、最後の発表は期待していただけに残念だった。(発表、ディスカッションするにはまだまだテーマとして早すぎたか)(同様5件)
- ブレイクスルーを成し遂げるためにはパッションが必要と考えるが、一般の学術集会では聞くことのできない研究側の発言と、それを規制の中でいかに実現すべきかを考えているレギュレーターの率直な意見交換が見られた。(同様3件)
- NGS等を活用した医薬品開発における課題と解決に向けた取り組みについて、明確となった。(レギュレーションは??ですが)(同様2件)
- バスケットTrial
- 臨機応変な対応が望めると感じられた。
- 懇親会非参加者は2,000円にしてほしい(選択可能にしてほしい)
- 地方からの参加者のために、場所を品川駅周辺の会議室にしてほしい
- 今回の参加者には次回のお知らせをメールで流してほしい
- 開催日は平日の方が良い
総合評価「普通&あまり良くなかった」と回答
- Q&Aが活発ではない。企業参加者ばかりで、アカデミア参加者が少ないからか。
今後取り上げるべき、興味のあるテーマ
【希少がん、希少フラクションの開発】
- 希少がん、希少フラクションの開発については、承認に至った前例が少なく、薬事規制の考え方が変わりうる領域であると考えるため、今後も継続して取り上げることが望ましいと考える。
- 再度「がん種横断的遺伝子変異効能開発と抗悪性腫瘍薬承認のあり方」
- 引き続き今回のような内容のアップデートの議題を取り上げて欲しい
- 希少がん開発
- アンブレラ、バスケットトライアルの具体例、実施する場合の問題点、注意点などについて
- バスケットスタディからクリニカルにつながった(つながる)ケース
- 希少フラクションにフォーカスすると早期に劇的な結果が得られPh2で申請するケースが多くなってくるため、CMCの対策をどうすべきかについて
【治験・医師主導治験】
- 未承認薬同士の治験と承認、PIのあり方
- コンパッショネートユース
- EAPの状況のアップデート
- EAPのあり方(拡大治験)
- RBMへの取り組み
- 医師主導治験の進め方
- 医師主導治験のグローバル展開
- EPOC等で実施された(医師主導)治験をPIIIにどのように展開していくのか興味がある。
- レジストリを利用した薬剤開発について
【開発環境など】
- アメリカに周回遅れから追いつけたのか
- バイデン副大統領が強調しているMoonshot/体制を超えた連携(USではシリコンバレーも参画、診断/治療/疫学)が動くと、やっと追いついてきたUSが再び先行することが懸念
- アカデミアシーズの企業開発について、アカデミア、企業の役割をそのようにしていくべきか?その対策は?また官がサポートすべきことは?
- シーズが日本でも国内でTR(translational)が行われず、直接海外へ導出されることが一般的になっている。F1 Humanから日本が主導して開発を進める戦略は、国内メーカー、ベンチャーも含め成り立つのか
- 海外DB(ゲノム情報を含む)の共有、活用を含めた医薬品の研究開発についての議論
- プライマリーカルチャーやバイオバンクを取り巻く環境、民間(外資)との協働
- 各国の状況(日本より進んでいるのか、韓国など)
- アジア内の協働(基礎と治験)
- 開発計画、デザインをいかにアグレッシブにするか?お作法を気にしないアグレッシブな米国開発と、お作法を気にするコンサバな日本の開発
- 具体的な事例に基づく企業からの演題
【新しい治療薬・治療法】
- 免疫チェックポイント阻害剤の研究~臨床開発
- がん免疫療法の次なるもの(がん幹細胞や、腸内細菌など)近頃どこに行ってもがん免疫療法なので。
- iPS細胞を用いた抗がん剤の開発の可能性
- 再生医療に関する内容
- 再生医療等性医薬品の臨床開発
- 遺伝子変異と安全性、副作用の発現状況の違い
- AMEDのプロジェクトの進捗と課題
- 創薬における失敗例など
【診断薬・診断機器】
- 新しい診断治療モダリティーの現況について
- リキッドバイオプシー(CTC, c+DNA)の将来性(薬事承認)
- リキッドバイオプシー等の診断が一般化、高感度化されると、病巣の見つからない患者(?)に対する治療の可能性も出てくるが、いかに対応すべきか。かねてより課題のアジュバントのエンドポイントになりうるかなど、検証試験の評価方も変わるべきではないか。
- CODX
- 次世代シーケンスのCDxとしての利用(承認と薬価・償還)
- IVD、Cox(NGS)承認後の保険点数についての考え方
- LDTの扱い→そこから保険償還のあり方
【低コスト化など】
- 個別化薬剤開発と薬価の問題
- 開発治験でのコスト・バリューの考え方
- 医療経済を踏まえた新薬の低コスト開発の可能性
- 医療経済的評価(高額化する医療費)
- 治療の実施、申請承認の高額化の対策、効率化の余地
- 日本版NICE導入がもたらす開発戦略への影響(エコノミカルなインパクトを産官学の立場で分析する)
- グローバル開発が進む中で、各国で有効性の評価と薬価の適正な評価をどのように定義していくのか
- 高薬価薬剤の適正使用基準(骨太の戦略であげられた)
①可能か? ②意味があるか? ③非人道的? - 皆保険で全ていけるのか、混合診療
【その他】
- 抗悪性腫瘍薬開発を促進するために、産官学の立場で人材育成をどのように行うのか?
- アカデミアからの参加を増やす企画
- 研究倫理(ノバルティスのディオバンなど)
- 薬剤の再評価(例、アスピリンのCRC予防作用)
- 今後の添付文書の取り扱い
- 課題に対して、産官学でもう少しディスカッションが盛り上がるともっと良い。今はそれぞれの立場をそれぞれ述べられているのから、あまり踏み込まれていない気がする。いつも違うテーマにすることがなく「その2」のような話を深めてもいい。
第21回フォーラム実行委員会
| 委員長 | 田村 研治(国立がん研究センター中央病院) |
| 副委員長 | 春日 芳朋(欧州製薬団体連合会/中外製薬株式会社) 北川 洋(欧州製薬団体連合会/ノバルティスファーマ株式会社) |
| 委員 | 井口 豊崇(医薬品医療機器総合機構) 大熊 伸一(米国研究製薬工業協会/日本イーライリリー株式会社) 柴辻 正喜(医薬品医療機器総合機構) 嶋本 隆司(米国研究製薬工業協会/MSD株式会社) 清水 俊雄(国立がん研究センター中央病院) 高見 朋子(米国研究製薬工業協会/MSD株式会社) 土原 一哉(国立がん研究センター先端医療開発センター) 永井 純正(東京大学医科学研究所) 橋本 順一(日本製薬工業協会/大塚製薬株式会社) 日野 敬晴(欧州製薬団体連合会/アストラゼネカ株式会社) 前田 英紀(日本製薬工業協会/アステラス製薬株式会社) 吉野 孝之(国立がん研究センター東病院) 藤田 直也((公財)がん研究会) 冨田 章弘((公財)がん研究会) 清宮 啓之((公財)がん研究会) |