挨拶
第20回の抗悪性腫瘍薬開発フォーラムを、2016年2月6日(土)に開催いたします。
今回のフォーラムは、高橋俊二実行委員長(がん研究会)、山田雅信副実行委員長(厚生労働省)、稲垣治副実行委員長(日本製薬工業協会/アステラス製薬株式会社)を迎え、「周回遅れからトップランナーへ~新しい開発に向けた課題と方向性~」をテーマに、準備を進めております。
是非ご参加いただけますようお願いいたします。
抗悪性腫瘍薬開発フォーラム
代表
武藤徹一郎
公益財団法人がん研究会
第20回抗悪性腫瘍薬開発フォーラムについて
この抗悪性腫瘍薬開発フォーラムが開始されて10年近くが経過しました。第1回(2006年7月)のテーマは「日本における抗がん剤の臨床開発~欧米からの周回遅れを挽回するために~」であり、drug lagの解消策検討が中心でした。その後、主要な癌におけるdrug lagはほぼ解消され、本邦でのFIH試験も増加し、また臨床試験の施行体制も整備されつつあります。
第20回となる今回のフォーラムでは「周回遅れからトップランナーへ~新しい開発に向けた課題と方向性~」と題して、創薬オープンイノベーション、医師主導試験の新たな取り組みについて産学官で御活躍中の演者をお招きして講演頂き、この10年間の歴史を踏まえながら、今後抗悪性腫瘍薬の開発で世界に先行するためには何をすべきかについて議論したいと考えております。
第20回抗悪性腫瘍薬開発フォーラム
実行委員長 高橋 俊二
公益財団法人がん研究会
開催概要
| 名称 | 第20回抗悪性腫瘍薬開発フォーラム 『周回遅れからトップランナーへ~新しい開発に向けた課題と方向性~』 |
|---|---|
| 日時 | 2016年2月6日(土)午後1時~6時 |
| 会場 | 吉田富三記念講堂(公益財団法人がん研究会がん研究所1F)アクセス 〒135-8550 東京都江東区有明3-8-31 |
| 参加費 | 4,000円(ミキサー費含む) 本フォーラムへの参加は事前登録制となっております。 |
| 参加受付 | 参加受付締切:2016年1月20日(水) ※定員になり次第、締め切らせていただきます。 |
| 参加申込み 方法 |
1. HPより参加登録をする。 2. 事務局より締切後、一週間程度で参加確認書をメールにて送信 3. 当日参加確認書を持参の上、参加費を受付で納入 ※上記の方法がとれない方は事務局にご相談下さい。 |
| 事務局 | 〒135-8550 東京都江東区有明3-8-31 (公財)がん研究会がん化学療法センター 担当:三原 TEL:03-3570-0661 FAX:03-3570-0484 E-mail: atdd-frm@jfcr.or.jp |
第20回抗悪性腫瘍薬開発フォーラム参加登録フォーム
締め切りました。プログラム
第20回フォーラムアンケートまとめ
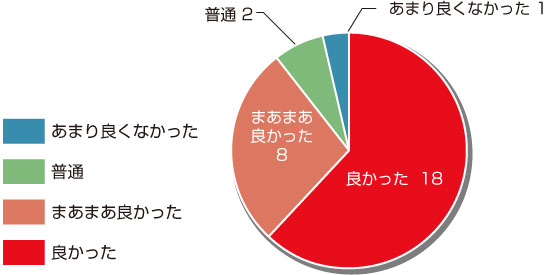
感想・意見
総合評価「良かった&まあまあ良かった」と回答
- 医師主導治験に関する現況と先生方の考え方を直接知ることができたことが良かったと思う。(他4件)
- 最新情報を入手できた(ex. JBCRGがGlobalに参加している国の取り組み)(他2件)
- 知見を広げることができた。(他1件)
- 規模が大きすぎず本音で開催できていること
- 開発の今が理解できたから
- 企業の人間でもアカデミアについて理解できた。おそらくその逆も然りだと思う。
- 各話題が短時間にもかかわらずコンパクトにまとめられており理解しやすかった。
- ウイルス治療など新しい研究分野のお話が(学会と違って)やすく近場で伺えたことが良かったと思います。
- 将来(4-5年)への予算対策として
総合評価「普通&あまり良くなかった」と回答
- 内容のレベル(対象聴衆)がマチマチ→もっとfocusするか、逆に複数のテーマにするか?
- 一方通行の講演→ワークショップ、事前アンケート、HP連動コンテンツなど、双方向性のコンテンツにしてみては?
- IISが婦人科に偏っていた
- 規制当局サイドの発表が既知の内容が大半を占めていた
今後取り上げるべき、興味のあるテーマ
治療法・診断法
- 希少がんの治療開発
- 日本で優位な(発生率?、疾患への理解?、診断の普及?)がん腫開発について
- 免疫治療
- 免疫療法も含めたバイオマーカー診断のあり方について(CDxを越えて)
- バイオマーカー(リキッドバイオプシー)
- コンパニオン診断薬など
- 一番は「創薬」である。次は医師主導治験(国際治験が進んでいる)、その次は市販後の医師主導治験です。
臨床研究・臨床開発
- 日本がこの領域で本当にglobalをリードするための具体的内容
- 今最もホットな話題であるバイデン副大統領のMoonshot for Cancer Cure 2020では、国を挙げての遺伝子情報と治療成果との包括的な管理/活用に動き出している(global standard化を狙っているだろう)。一方、日本はがん種だけでもなかなかまとまっていない。SCRAM-Japanもがん種別だが、All Japanではない。分子標的はがん種を超えた概念である。このあたり、どう考え/進めるべきか、Big data取り扱いも含めて
- アカデミアの先生方との協力で新しい製品、エビデンスを創出していくことはますます重要になってきますので、臨床研究の法制化やGlobal study groupに参加しての医師主導治験による影響、新たな課題を薬事制度、業界自主基準作成によりいかにして乗り越えるかの議論ができればと思います。
- 抗悪性腫瘍薬の臨床開発のノウハウ
- 医師主導治験のDrとメーカーとPMDAのパネルディスカッション
- Combination therapyデザイン(産官学)
治験・臨床試験
- Global FIH試験を実施する上での留意点、工夫
- 効率の良い臨床試験の実施方法(症例数を下げるデザイン等)
- 治験、臨床研究を含む臨床試験におけるデータの信頼性について、医師、CRC、依頼者それぞれの考え方をどこまで擦り合わせていけるか。
- IISの状況
- 治験参加施設-医師の扱い方
- 市販後医師主導治験、JCOGを中心とする試験のあり方
- RMP
- 臨床試験における契約の考え方
資金・コスト・利益配分
- 実際に臨床試験を運営するのに”お金”の流れや、拠出する方法を各論からご提案いただき、ruleを明確にしていただきたいので、そのようなテーマをお願いします。(各話者から具体的な方法について語られていなかったため)
- なぜ日本の治験(特に医師主導治験)費用が海外と比べてあまりに高いのか。原因と解決策をARO/CRO等を含めた各ステークホルダーが参加して、集中的に討論する場が必要だと思います。日本の医師主導治験の国際的な競争力はサイエンスレベルに比べて低いと言わざるを得ず、その主たる原因は高コスト体質であると考えています。
- 臨床試験コストを下げることの可能性について
- CROコスト等に関する内容は興味深く思います。
- 金-ファンディングの得方
- アカデミア創出あるいは連携して実施し、結果的に承認(商業化)された場合の利益の分配はどうなっているのか。
業界ほか
- 業界全体の基本的な仕組み(若手向け、開発に関わるようになったDrなど向けに)
- より密な、ハードルの低い産学官のコミュニケーションの仕方
- 業界におけるキャリア形成、求められる人材像
- 医療経済や治療費に関して取り上げていただきたい
第20回フォーラム実行委員会
| 委員長 | 高橋 俊二((公財)がん研究会) |
| 副委員長 | 山田 雅信(厚生労働省) 稲垣 治(日本製薬工業協会/アステラス製薬株式会社) |
| 委員 | 大熊 伸一(米国研究製薬工業協会/日本イーライリリー株式会社) 春日 芳朋(欧州製薬団体連合会/中外製薬株式会社) 河原 英治(米国研究製薬工業協会/MSD株式会社) 河野 典厚((独)医薬品医療機器総合機構) 藤原 恵一(埼玉医科大学) 前田 英紀(日本製薬工業協会/アステラス製薬株式会社) 土井 俊彦(国立がん研究センター東病院) 橋本 順一(日本製薬工業協会/大塚製薬株式会社) 藤田 直也((公財)がん研究会) 冨田 章弘((公財)がん研究会) 清宮 啓之((公財)がん研究会) |