挨拶
第18回の抗悪性腫瘍薬開発フォーラムを、2015年2月21日(土)に開催いたします。
今回のフォーラムは土原一哉実行委員長(国立がん研究センター)、北川洋副実行委員長(欧州製薬団体連合会/グラクソ・スミスクライン株式会社)のもと、『次世代テクノロジーは抗がん剤開発に何をもたらすか?~分子生物学的臨床開発基盤構築に向けて~』をテーマに準備を進めております。
是非ご参加いただけますようお願いいたします。
抗悪性腫瘍薬開発フォーラム
代表
武藤徹一郎
公益財団法人がん研究会
第18回抗悪性腫瘍薬開発フォーラムについて
各種のバイオマーカーにより層別化される患者集団に対する治療薬の最適化は昨今の抗がん治療開発の基本であり、バイオマーカーと治療薬の組み合わせは今後もより複雑化すると予想されます。こうした背景のもと全国規模での患者スクリーニングやアンブレラ型、バスケット型の臨床試験など開発における新しい取り組みが盛んに行われるようになってきました。さらに治療選択のための複数のバイオマーカーの同時診断の必要性は実地診療においても切実なものとなりつつあります。Biomarker-based medicineの最新の知見を遅滞なく患者のもとに届けるためどんな取り組みが必要なのか、産学官から第一人者が一堂に集まり最良の解決策を探りたいと思います。
第18回抗悪性腫瘍薬開発フォーラム
実行委員長
土原 一哉
国立がん研究センター
開催概要
| 名称 | 第18回抗悪性腫瘍薬開発フォーラム 『次世代テクノロジーは抗がん剤開発に何をもたらすか?~分子生物学的臨床開発基盤構築に向けて~』 |
|---|---|
| 日時 | 2015年2月21日(土)午後1時~6時00分 |
| 会場 | 吉田富三記念講堂(公益財団法人がん研究会がん研究所1F)アクセス 〒135-8550 東京都江東区有明3-8-31 |
| 参加費 | 4,000円(ミキサー費含む) 本フォーラムへの参加は事前登録制となっております。 |
| 参加受付 | 参加受付締切:2015年1月23日(金) ※定員になり次第、締め切らせていただきます。 |
| 参加申込み 方法 |
1. HPより参加登録をする。 2. 事務局より締切一週間程度で参加確認書をメールにて送信 3. 当日参加確認書を持参の上、参加費を受付で納入 ※上記の方法がとれない方は事務局にご相談下さい。 |
| 事務局 | 〒135-8550 東京都江東区有明3-8-31 (公財)がん研究会がん化学療法センター 担当:三原 TEL:03-3570-0661 FAX:03-3570-0484 E-mail: atdd-frm@jfcr.or.jp |
第18回抗悪性腫瘍薬開発フォーラム参加登録フォーム
登録を締め切りました。
プログラム
第18回フォーラムアンケートまとめ
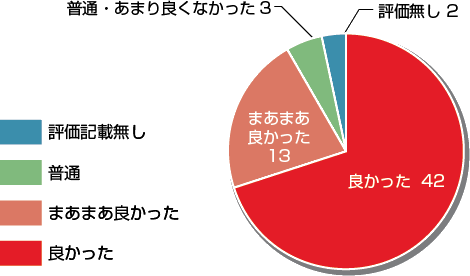
感想・意見
総合評価「良かった&まあまあ良かった」と回答
- いずれのプレゼンターも現場で直接携わっているため、まさに現場の声が聞かれ、課題などが明確だったこと。それを元にディスカッションがなされたこと。(他4件)
- NGSについて、国内外の規制当局、産官学がどのように考え、今後どのような計画があるのかがよくわかった。(他3件)
- それぞれのテーマが密接に関連しあっており、NGSを臨床応用するための課題について体型的に理解できた。(他9件)
- アカデミア、クリニック、行政、ファーマ、診断薬という様々な立場の人が集まる会で、NGSを中心に今の情報を共有してもらえた。(他5件)
- 産官学それぞれの視点から、一つ一つの演題の時間は限られていた分、まとまった話を聞くことができた。(他7件)
- 官の回答にはがっかりした。
- NGSの話はまさに知りたいところだった。RASの話も興味深かった。
- 少し専門的すぎた。理解を深めるためにスライドのハンドアウトを配布いただきたかった。
- 医薬品開発の視点からのコンパニオンの話がもう少しあったらよかった。
- 総合討論のファシリテートがもう少し円滑だとより良かった。あまり司会が話しすぎるのも、と思うが、もう少し誘導した方が活発な討論になったのでは?と思う。
- 問題点は共有できたが結論には至らなかったか。
- 規制上の問題がなかなか解決されないが、できるだけ早く、解決されることを望みます。
総合評価「普通&あまり良くなかった」と回答
- 初めて本フォーラムに参加したが、産官学それぞれの主張、意見を一度に聞くことができ、とても貴重な経験になった。
今後取り上げるべき、興味のあるテーマ
希少フラクション/ドライバー遺伝子変異
- 腫瘍の新しい分類法の提案(例えばALKomaなどのように)とその分類に基づいた治療法の選択や、PROS/CONS、課題
- 共通のがん遺伝子を持つ多がん種の開発承認について
- 臓器横断的な抗がん剤の開発について
- 非常にRareながんの開発、filingに必要な臨床試験について(データについて)
- 患者数が極めて少ない場合の、CDx(保険点数含む)の考え方について
NGS/IVD
- NGSの議論は今後も続けて欲しいです。
- 引き続き、NGSの動向をチェックしたい。
- 引き続きNGSを用いたIVDについてや日本版CLIA-LDTについてNGS+multipleyをどうやって規制当局に認めさせるか?
- NGSを使用した検査を臨床で使用、利用する際の評価指標、解析フロー、評価の仕組み
- 今回を踏まえてその後どうなったかについて
- IVD新規申請品の保護期間について
新薬開発、治験・臨床試験
- 薬剤の基礎研究から治験の期間が短くなる中で、ファーマの取っている対応
- 治験の進め方が変わりつつある中でPMDA、ファーマの各社が取っている対応について
- 日米欧での承認制度の違い(accelerated approval、さきがけ制度?など)興味があります。
- 治験実施費用、契約手続きの均一化、費用が高いため、日本で治験ができなくなる。
腫瘍免疫/がん免疫療法
- 腫瘍免疫、がん免疫療法について
- 免疫細胞療法に対する規制要件等についてのアップデート
- PD-1 PD-L1 inhibitor、効果と耐性、治療薬の開発
その他
- 分子標的薬開発における成功例、失敗例。その原因、今後の改善点
- AMED設立後の研究開発体制の実際と課題
- それぞれの機関の連携をどうとっていくかなど
第18回フォーラム実行委員会
| 委員長 | 土原 一哉(国立がん研究センター) |
| 副委員長 | 北川 洋(欧州製薬団体連合会/グラクソ・スミスクライン株式会社) |
| 委員 | 春日 芳朋(欧州製薬団体連合会/中外製薬株式会社) 嶋本 隆司(米国研究製薬工業協会/MSD株式会社) 吉塚 直人(米国研究製薬工業協会/日本イーライリリー株式会社) 田村 研治(国立がん研究センター中央病院) 橋本 順一(日本製薬工業協会/大塚製薬株式会社) 日野 敬晴(欧州製薬団体連合会/アストラゼネカ株式会社) 前田 英紀(日本製薬工業協会/アステラス製薬株式会社) 山田 雅信((独)医薬品医療機器総合機構) 山中 竹春(横浜市立大学) 山本 景子(米国研究製薬工業協会/MSD株式会社) 清宮 啓之((公財)がん研究会) 冨田 章弘((公財)がん研究会) 藤田 直也((公財)がん研究会) |