挨拶
第15回の抗悪性腫瘍薬開発フォーラムを、2013年6月15日(土)に開催いたします。
今回のフォーラムは実行委員長に大津敦先生(国立がん研究センター)、副委員長に春日芳朋様(欧州製薬団体連合会/中外製薬株式会社)をお迎えして、「ポストゲノム時代をリードする新薬開発~Molecular profiling directed therapy~」をテーマに準備を進めております。
是非ご参加いただけますようお願いいたします。
抗悪性腫瘍薬開発フォーラム 代表
武藤徹一郎
公益財団法人がん研究会
第15回抗悪性腫瘍薬開発フォーラムについて
次世代シークエンサーを始めとしたゲノム解析技術の進歩と多数の有効分子標的治療薬の出現により個別化治療の実現が現実味を帯びている。ゲノムプロファイルによる個別化治療はがん治療の大きなトピックとなっているが、同時に多数の希少フラクションを産みだすことになり、新薬開発試験のデザインや方法論、承認条件などを大きく変えつつある。今回のフォーラムでは最先端の取り組みを行っている産官学の各分野のリーダーの方々にご発表いただき、ポストゲノム時代における希少疾患や希少フラクションでの新薬開発試験をどのように進めるべきかについて最新のデータを交えて討論したい。
第15回抗悪性腫瘍薬開発フォーラム
実行委員長
大津 敦
国立がん研究センター
開催概要
| 名称 | 第15回抗悪性腫瘍薬開発フォーラム 「ポストゲノム時代をリードする新薬開発~Molecular profiling directed therapy~」 |
|---|---|
| 日時 | 2013年6月15日(土)午後1時~5時55分 |
| 会場 | 吉田富三記念講堂(公益財団法人がん研究会がん研究所1F)アクセス 〒135-8550 東京都江東区有明3-8-31 |
| 参加費 | 4,000円(ミキサー費含む) 本フォーラムへの参加は事前登録制となっております。 |
| 参加受付 | 参加受付締切:2013年5月31日(金) ※定員になり次第、締め切らせていただきます。 |
| 参加申込み 方法 |
1. HPより参加登録をする。 2. 事務局より締切一週間程度で参加確認書をメールにて送信 3. 当日参加確認書を持参の上、参加費を受付で納入 *上記の方法がとれない方は事務局にご相談下さい。 |
| 事務局 | 〒135-8550 東京都江東区有明3-8-31 (公財)がん研究会・がん化学療法センター 担当:三原 TEL:03-3570-0661 FAX:03-3570-0484 E-mail: atdd-frm@jfcr.or.jp |
第15回抗悪性腫瘍薬開発フォーラム参加登録フォーム
締め切らせていただきました。
プログラム
第15回フォーラムアンケートまとめ
第15回抗悪性腫瘍薬開発フォーラムにご参加いただき、またアンケートに対し大変多くの貴重なご意見をいただきまして、誠にありがとうございました。
これらの貴重なご意見は、フォーラム運営サイドのみではなく、参加いただきました皆様とシェアすることにより、今後のフォーラムの発展により役に立つものと考えております。なお、本アンケート結果のまとめは、同様なご意見をひとつにまとめるなど、必ずしも原文と同一ではないこと、ご了承ください。
今後ともフォーラムへのご支援賜りますよう、どうぞよろしくお願い申し上げます。
第15回抗悪性腫瘍薬開発フォーラム 実行委員会
感想・意見
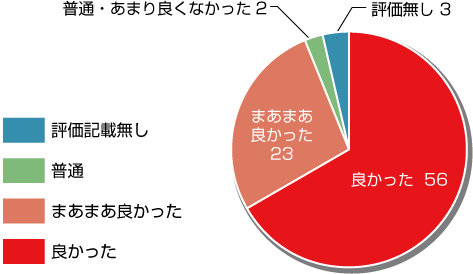
総合評価「良かった&まあまあ良かった」と回答
- 希少フラクションの癌の開発というタイムリーな疑問にアカデミア/産/官からいろいろな側面から掘り下げて戴き大変参考になりました。(他8件)
- 実際に試験を運営されている先生方の経験からの具体的な話がお聞きできたので課題や現状がわかりやすい。(他4件)
- 多くの会社が個別化医療に取り組む中、「ゲノム解析による希少フラクションの新薬開発」の共同検討のお話がとても興味深かった。実現できれば、症例が入りにくくコストがかかると言われる日本の治験の活性化にも繋がると考える。(他3件)
- 産官学それぞれの専門家が最先端の取り組みについて紹介され、いかに効率よく医薬品の開発と承認申請、審査を行い、患者さんに届けることができるかディスカッションされた事。(他20件)
- 向山先生のScreening networkは開発コストの低減のみならず、ゲノム情報の蓄積、Multiplex diagnosisへの発展等、様々な可能性を持った試みであるのではと、大変関心を持つ事ができました。(他1件)
- アクセス制度(CV)の議論
- Genome情報にnational asset
- 第14回(参加せず)との関係性が想像できた
- 具体的な解決方法の議論が少なかった。Compassionate Use.
- 可能であれば発表資料をいただけるとありがたいです。
総合評価「普通&あまり良くなかった」と回答
- 内容に関しては「希少」を軸にしながらも抗がん剤開発の将来像全般の議論であったので満足しています。(他3件)
- PMDAの新薬5部の部長が講演以外でも積極的に議論に参加されたのが大変良かったです。(他1件)
- NCCEの取り組みに代表される成功例の共有が非常に素晴らしい。(他3件)
- 議論が白熱するのはいつものことなので、Agendaにゆとりを持った方が良い。
- 発言されている用語が難しく、話について行けない部分が多かった。事前に知っておいた方が良い用語をHP等で開示してあると親切だと感じた。
- 概念的な一般的な演題が多かったため、医師主導試験の演題が主であるのに対し、製薬会社からの参加者が主であった。
- 希少がんの開発とコンパッショネートコースの話。すでに海外で有効性が示されているものの場合で、まだinvestigationalなものを使う場合の話が混同して話がされていたように思える。又、承認でなくても保険償還でおぎなう日本版コンペンディアのお話は一切なかった。2つの気色の違うものが1つのディスカッションでされたのがなんかすっきりしない理由
- 理想と現実の折り合いをどうつけていくかという問題はいつも難しいが、open discussion の場の提供を待っているよりはむりやりでも少しずつ前に進みながら検証を繰り返していくより他ないのでは。
- 問題提起、改善案の提案がなされても、そこに実際に産官学がどのように関与し、また解決に結びつけるのか、具体的議論まで進むことはあまりないように思う。将来的なことへコミットする発言をするのは難しいと思いますが、総合討論を長くするなどして深い議論ができるとより面白いフォーラムになると思う。
- セミナー室Bが大変寒かったので空調への配慮をお願いしたい。
- サロゲートエンドポイント
総合評価 無回答
- 企業が手を着けにくい希少がんについて問題点、医療機関、規制当局の考えをお聞きすることが出来、開発担当者としては大変勉強になったが、より具体的なガイドライン等の作成等の検討があればとも思った。
- 国がんのがん研究の熱心さが良く分かった。
今後取り上げるべき、興味のあるテーマ
| 希少フラクション/CoDx |
|
|---|---|
| グローバル開発 |
|
| アジアにおける役割 |
|
| 抗がん剤開発全般 |
|
| インフラ整備、その他 |
|
第15回フォーラム実行委員会
| 委員長 | 大津 敦 | (国立がん研究センター東病院) |
|---|---|---|
| 副委員長 | 春日 芳朋 | (欧州製薬団体連合会/中外製薬株式会社) |
| 委員 | 大津 智子 | (欧州製薬団体連合会/バイエル薬品株式会社) |
| 粕谷 美南子 | (米国研究製薬工業協会/ファイザー株式会社) | |
| 金崎 雅之 | (欧州製薬団体連合会/グラクソ・スミスクライン株式会社) | |
| 佐瀬 一洋 | (順天堂大学) | |
| 下永 応博 | (欧州製薬団体連合会/メルクセローノ株式会社) | |
| 鈴木 正紀 | (日本製薬工業協会/第一三共株式会社) | |
| 谷合 央 | (米国研究製薬工業協会/日本イーライリリー株式会社) | |
| 橋本 順一 | (日本製薬工業協会/大塚製薬株式会社) | |
| 前田 英紀 | (日本製薬工業協会/アステラス製薬株式会社) | |
| 松浦 義昌 | (COTEC/中外製薬株式会社) | |
| 森 和彦 | ((独)医薬品医療機器総合機構) | |
| 清宮 啓之 | ((公財)がん研究会) | |
| 冨田 章弘 | ((公財)がん研究会) | |
| 藤田 直也 | ((公財)がん研究会) |