ごあいさつ
第13回の抗悪性腫瘍薬開発フォーラムを、2012年6月16日(土)に開催致します。
今回のフォーラムは実行委員長に赤座英之先生(東京大学)、副委員長に小林利彦様(米国研究製薬工業協会)をお迎えして、「Revisiting JPN-全例調査」をテーマに準備を進めております。
是非ご参加いただけますようお願い致します。
抗悪性腫瘍薬開発フォーラム 代表
武藤徹一郎
公益財団法人がん研究会
開催概要
| 名称 | 第13回抗悪性腫瘍薬開発フォーラム 「Revisiting JPN-全例調査」 |
|---|---|
| 日時 | 2012年6月16日(土)午後1時~6時45分 |
| 会場 | 吉田富三記念講堂(公益財団法人がん研究会がん研究所1F)アクセス 〒135-8550 東京都江東区有明3-8-31 |
| 参加費 | 4,000円(ミキサー費含む) 本フォーラムへの参加は事前登録制となっております。 |
| 参加受付締切 | 2012年5月31日(木) |
| 参加申込み 方法 |
1. HPより参加登録をする。 2. 事務局より締切一週間程度で参加確認書をメールにて送信 3. 当日参加確認書を持参の上、参加費を受付で納入 *上記の方法がとれない方は事務局にご相談下さい。 |
| 事務局 | 〒135-8550 東京都江東区有明3-8-31 (公財)がん研究会・がん化学療法センター 担当:三原 TEL:03-3570-0661 FAX:03-3570-0484 E-mail: atdd-frm@jfcr.or.jp |
第13回抗悪性腫瘍薬開発フォーラム参加登録フォーム
プログラム
第13回フォーラムアンケートまとめ
第13回抗悪性腫瘍薬開発フォーラムにご参加いただき、またアンケートに対し大変多くの貴重なご意見をいただきまして、誠にありがとうございました。
これらの貴重なご意見は、フォーラム運営サイドのみではなく、参加いただきました諸先生方とシェアすることにより、今後のフォーラムの発展により役に立つものと考えております。なお、本アンケート結果のまとめは、同様なご意見をひとつにまとめるなど、必ずしも原文と同一ではないこと、ご了承ください。
今後ともフォーラムへのご支援賜りますよう、どうぞよろしくお願い申し上げます。
第13回抗悪性腫瘍薬開発フォーラム 実行委員会
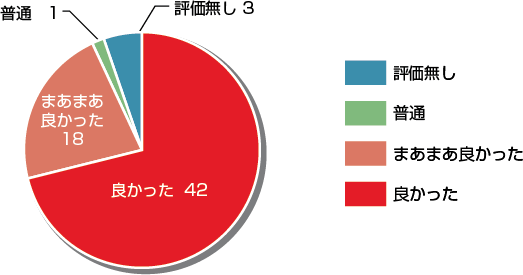
感想・意見
総合評価「良かった&まあまあ良かった」と回答
- 全例調査の実態、意義、業績を詳細に検討する機会が持てた。(他29件)
- 市販後の手間と価値についての議論があり、今後はどのようにして行くのが良いかを議論するトリガーになったと思うから。(他8件)
- 規制要件に関するテーマについて、臨床医や企業の意見が交わされただけでなく、当局側の将来へ向けた考えも聞くことができ、明るい展望が持てた。(他12件)
- 司会のリードが適切であった。
- 時間配分が良かった。
- 総合討論の時間をもう少し長くして欲しかった。
- 発表者のスライド資料が欲しい。
- 飲物が最初から欲しい
- Risk/benefitバランスの評価について、今後も情報を発信してもらいたい。
- 海外との比較が分かりやすかった。
- 市販後の毒性確認など必要と考えるが、質を保つ精度を上げないと、サイエンスにはならないと感じる。
総合評価「普通&あまり良くなかった」と回答
- テーマに関して、言葉の定義や事実認識などの一致した理解を得る為の工夫が有ると、建設的な議論が進むのでは?
総合評価 無回答
- 最近の全例調査についての各方面の意見が聞けて良かった。
- 全例調査負担軽減の取り組みへの方向性が議論された事。
今後取り上げるべき、興味のあるテーマ
| 治験・臨床試験について |
|
|---|---|
| 希少薬・個別化医療について |
|
| 臨床開発、規制、承認・申請ほか |
|
| 市販後調査ほか |
|
| その他 |
|
第13回フォーラム実行委員会
| 委員長 | 赤座 英之 | (東京大学) |
|---|---|---|
| 副委員長 | 小林 利彦 | (米国研究製薬工業協会) |
| 委員 | 江口 弘次 | (欧州製薬団体連合会/メルクセローノ株式会社) |
| 大園 誠一郎 | (浜松医科大学) | |
| 春日 芳朋 | (欧州製薬団体連合会/中外製薬株式会社) | |
| 粕谷 美南子 | (米国研究製薬工業協会/ファイザー株式会社) | |
| 佐藤 岳幸 | (医薬品医療機器総合機構) | |
| 澤田 高志 | (日本製薬工業協会/エーザイ株式会社) | |
| 島田 安博 | (国立がん研究センター中央病院) | |
| 鈴木 正紀 | (日本製薬工業協会/第一三共株式会社) | |
| 谷合 央 | (米国研究製薬工業協会/日本イーライリリー株式会社) | |
| 橋本 順一 | (日本製薬工業協会/ファイザー株式会社) | |
| 松浦 義昌 | (COTEC/中外製薬株式会社) | |
| 清宮 啓之 | (がん研究会) | |
| 冨田 章弘 | (がん研究会) | |
| 藤田 直也 | (がん研究会) |